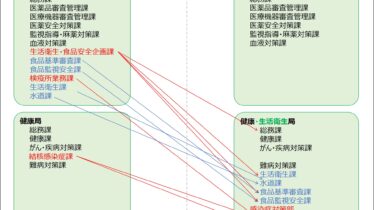
 薬事関連
薬事関連 2023年9月厚労省組織図、「医薬・生活衛生局」→「医薬局」
こんにちは、ジンです。先日の内閣改造により厚生労働大臣が変わってしまいましたねー。ジン私は加藤勝信さんから薬剤師免許証の交付を受けましたのでちょっぴり寂しい気持...Click to continue
 薬事関連
薬事関連 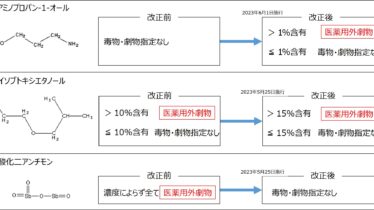 毒劇物規制
毒劇物規制  薬事関連
薬事関連  体外診断用医薬品
体外診断用医薬品  薬事関連
薬事関連