通常、体外診断用医薬品は、特に使用成績の確認が必要と判断される場合を除き、使用成績調査の実施や調査結果の厚生労働大臣への報告は法令上義務付けられていません。
一方で、緊急承認された体外診断用医薬品では、使用成績調査の実施と報告が法律で義務付けられています。
緊急承認制度は、緊急時に、安全性の確認・有効性の推定をもって迅速に薬事承認する制度であり、緊急時に迅速な承認が可能となるというメリットの反面、承認時のデータが極めて限られているため予測できない不具合があるかもしれないというリスクもあります。
緊急承認時の使用成績調査では、当該体外診断用医薬品の不具合による重大な健康被害がないかどうかを、製造販売(承認)後に調査します。
本ページでは、緊急承認における使用成績調査の取り扱いについて根拠法令とともにご紹介します。
医薬品医療機器等法
緊急承認を受けた者は使用成績調査を実施し、大臣に報告
さっそくですが、まずは関連する法律の条文をご紹介します。
緊急承認時の使用成績調査に関する規定は、医薬品医療機器等法の<第23条の2の6の2第4項>に書かれています。
こちらが根拠となる条文です↓↓
<第23条の2の6の2第4項>
第1項の規定により条件及び期限を付した第23条の2の5の承認を受けた者は、厚生労働省令で定めるところにより、当該医療機器又は体外診断用医薬品の使用の成績に関する調査その他厚生労働省令で定める調査を行い、その結果を厚生労働大臣に報告しなければならない。
令和4年法律第47号による改正後の医薬品医療機器等法(2022年5月20日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
使用成績調査の実施と結果の報告について記載されています。
- 緊急承認を受けた人(法人)は、使用成績調査を実施してください。
- 使用成績調査を実施したら、結果を厚生労働大臣に報告してください。
- 使用成績調査の実施や報告の方法は厚生労働省令で定めます。
条文中に「その他厚生労働省令で定める調査」とありますが、今のところは定められていませんので、使用成績調査のみを実施、報告することになります。
使用成績調査の実施や報告の方法については、「厚生労働省令で定める」とのことですので、厚生労働省令を確認してみましょう。
【省令条文】使用成績調査の実施と報告の方法
「厚生労働省令」とありますが、ここでは「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則(昭和36年厚生省令第1号)」のことを意味しています。
緊急承認時の使用成績調査の実施や報告の方法については、医薬品医療機器等法施行規則<第114条の36の2>で定められています。
まずは実施の方法についてです。第1項に書かれています。
<第114条の36の2第1項>
法第23条の2の6の2第1項の規定により条件及び期限を付した法第23条の2の5の承認を受けた医療機器又は体外診断用医薬品につき当該承認を受けた者が行う法第23条の2の6の2第4項の調査は、当該期限(同条第3項の規定による延長が行われたときは、その延長後のもの)までの期間、当該医療機器又は体外診断用医薬品の不具合によるものと疑われる疾病、障害若しくは死亡又はその使用によるものと疑われる感染症その他の使用の成績等について行うものとする。
令和4年厚生労働省令第84号による改正後の医薬品医療機器等法施行規則(2022年5月20日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
色々ゴチャゴチャと書かれていますが、大事なところをピックアップすると次の3点です。
- 使用成績調査は、(指示された日から)承認の期限までの期間実施してください。
- 緊急承認の期限が延長された場合は、延長後の期限までの期間実施してください。
- 使用成績調査では当該製品が原因と疑われる疾病、障害、死亡、感染症等について調査してください。
調査の期間と調査するべき事項について規定されていますね。
使用成績調査の期間については、緊急承認時に厚生労働大臣が指示した日から緊急承認の期限までの間、実施することと規定されています。
緊急承認の期限が延長された場合には使用成績調査の終了日も同じく延長されます。
緊急承認を受けて製造販売している期間は使用成績調査が必要と考えておけば間違いないでしょう。
緊急承認の期限についてはこちらのページで詳しく書いています。
また、第1項では調査するべき事項についてもいくつか挙げられています。
- 製品の不具合が原因と疑われる次の事例を調査
- 疾病
- 障害
- 死亡
- 製品の使用が原因と疑われる次の事例を調査
- 感染症発生
疾病、障害、死亡の事例においては製品の不具合が原因と疑われるものについて調査することになっています。
一方で感染症発生の事例においては、製品の使用が原因と疑われるもの(事例の原因が製品の不具合のみに限定されていない)について調査することになります。
続いては報告の方法についてです。同条第2項に書かれています。
<第114条の36の2第2項>
法第23条の2の6の2第4項の規定による厚生労働大臣に対する報告は、当該調査に係る医療機器又は体外診断用医薬品の製造販売の承認の際に厚生労働大臣が指示した日から起算して1年(厚生労働大臣が指示する医療機器又は体外診断用医薬品にあつては、厚生労働大臣が指示する期間)ごとに、その期間の満了後2月以内に行わなければならない。
令和4年厚生労働省令第84号による改正後の医薬品医療機器等法施行規則(2022年5月20日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
- 使用成績調査の結果は、1年ごとに報告してください。
- 厚生労働大臣が期間を指示する場合はその期間ごとに報告してください。
- 報告の期限は、期間が満了してから2か月以内です。
報告の間隔と期限について記載されていますね。
基本的には1年ごとに報告していくことになりますが、厚生労働大臣が期間を指示した場合にはそれに従った間隔で報告します。
報告の間隔が1年ごとでも指示された期間ごとでも、その期間の終了後2か月以内に調査結果を報告しなければなりません。
使用成績調査の期間と報告の間隔について図にしてみました。
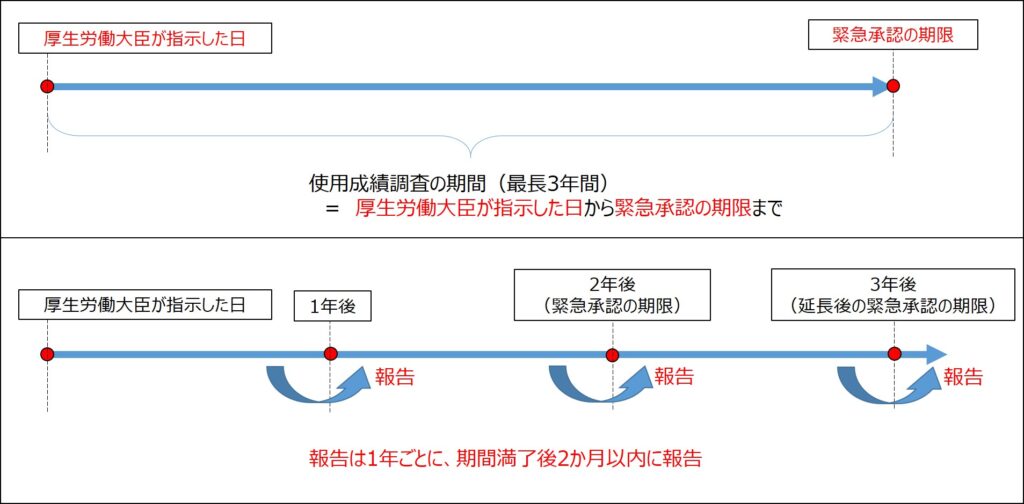
緊急承認の期限が延長された場合、最長で3年間となります。
通常は1年ごとに報告が必要ですので、緊急承認を受けている期間中に3回の報告をすることになります。
法第23条の2の9の使用成績調査との違い
上記では2022年5月20日改正による緊急承認時の使用成績調査についてご紹介していますが、使用成績調査という言葉は改正以前から存在していました。
- 通常承認(第23条の2の5第1項の承認)
- 条件付き承認(第23条の2の5第12項の規定による第23条の2の5第1項の承認)
- 特例承認(第23条の2の8第1項の規定による第23条の2の5第1項の承認)
の際の使用成績調査は、もともと法第23条の2の9で規定されていました(改正後も同条で規定されています)。
緊急承認以外の承認時の使用成績調査についてはまた別記事にまとめたいと思いますが、ここでは簡単に緊急承認時の使用成績調査との比較をまとめておきたいと思います。
※緊急承認以外の承認時の使用成績調査については、特に使用成績の確認が必要と判断される場合にのみ実施されるため、法律上規定はあるものの実際に運用された例はないと思われます。
報告方法の詳細(様式等)はある?
緊急承認以外の承認時の使用成績調査では、厚生労働省の通知で報告様式が定められています。
- 平成26年11月21日 薬食機参発1121第44号「医療機器及び体外診断用医薬品の製造販売承認に係る使用成績評価の取扱いについて」
別紙様式1 製造販売後調査等報告書(厚生労働省ホームページ)
それでは、緊急承認時の使用成績調査の際の報告様式はどこかで定められているのでしょうか?
記事作成時点では、緊急承認時の報告様式はまだ定められていません。

まだ、緊急承認の事例自体がないですからねぇ~
新たな通知が発出されるのか、上記の通知を準用する趣旨の通知が発出されるのかは分かりませんが、実際に体外診断用医薬品の緊急承認が想定される状況になってきたときには報告様式が示されると思います。
また、新たな情報があれば更新したいと思います。
使用成績評価申請は必要か?
緊急承認以外の体外診断用医薬品の承認時の使用成績調査では、使用成績調査期間(3年)が終了した後に調査結果をまとめて、厚生労働大臣の評価を受けなければなりません。
厚生労働大臣に評価してもらうためには「使用成績評価申請」をします。
緊急承認時には使用成績評価申請は必要なのでしょうか?
緊急承認時には使用成績評価申請は必要ありません。
緊急承認では他の承認方法と異なって承認の期限が定められており、期限終了前に再度承認申請をしなければなりません。
この期限前の再度の承認申請時には、使用成績調査結果に関する資料を添付して申請することにより、承認審査の中で使用成績調査結果についても評価されますので、改めて評価申請をする必要はありません。
緊急承認では使用成績評価申請が必要ない旨が条文中にもはっきりと記載されています。
<第23条の2の9第1項>
厚生労働大臣が薬事審議会の意見を聴いて指定する医療機器又は体外診断用医薬品につき第23条の2の5の承認(第23条の2の6の2第1項の規定により条件及び期限を付したものを除く。第6項において同じ。)を受けた者又は当該承認を受けている者は、当該医療機器又は体外診断用医薬品について、厚生労働大臣が指示する期間(次項において「調査期間」という。)を経過した日から起算して3月以内の期間内に申請して、厚生労働大臣の使用成績に関する評価を受けなければならない。
令和4年厚生労働省令第84号による改正後の医薬品医療機器等法施行規則(2022年5月20日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
- 承認時に指定を受けた場合は使用成績に関する評価を受けてください。
- ただし、緊急承認(第23条の2の6の2第1項の規定による第23条の2の5の承認)の場合は除きます。
…と、こんな感じです。
緊急承認時には使用成績評価申請は必要ありません。
まとめ
本ページでは緊急承認の際の使用成績調査の実施や結果の報告ついて、その根拠を実際の法令を見ながら確認しました。
体外診断用医薬品では、まだ緊急承認をもくした品目が出てきていませんので、報告様式等の詳細は定められていない状況です。
今後の動向に注視していきたいと思います。
以上です!ありがとうございました!


コメント