体外診断用医薬品の製造販売承認の種類のひとつに「緊急承認」というものがあります。
緊急承認制度は、緊急時に、安全性の確認・有効性の推定をもって迅速に薬事承認する制度です。
緊急承認では、いくつかの承認要件を免除することで、承認までにかかる時間を最大限に短縮し迅速に承認するための措置が取られます。
迅速に承認されるからといって、全ての体外診断用医薬品を緊急承認することはできません。
緊急承認されるためには、ある要件を満たす体外診断用医薬品である必要があります。
本ページでは、緊急承認の対象となるための要件や、緊急承認の際に免除される規定について解説します。
医薬品医療機器等法
根拠条文
さっそくですが、まずは関連する法律の条文をご紹介します。
緊急承認の対象となるための要件や承認時に免除される規定は、医薬品医療機器等法の<第23条の2の6の2>の第1項に書かれています。
こちらが根拠となる条文になります。
<第23条の2の6の2第1項>
第23条の2の5の承認の申請者が製造販売をしようとする物が、次の各号のいずれにも該当する医療機器又は体外診断用医薬品として政令で定めるものである場合には、厚生労働大臣は、同条第2項(第3号ハに係る部分を除く。)、第6項、第7項、第9項及び第11項の規定にかかわらず、薬事審議会の意見を聴いて、その適正な使用の確保のために必要な条件及び2年を超えない範囲内の期限を付してその品目に係る同条の承認を与えることができる。
令和5年法律第36号による改正後の医薬品医療機器等法(2024年4月1日施行)
一 国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延その他の健康被害の拡大を防止するため緊急に使用されることが必要な医療機器又は体外診断用医薬品であり、かつ、当該医療機器又は体外診断用医薬品の使用以外に適当な方法がないこと。
二 申請に係る効果又は性能を有すると推定されるものであること。
三 医療機器にあつては、申請に係る効果又は性能に比して著しく有害な作用を有することにより医療機器として使用価値がないと推定されるものでないこと。
原文は 総務省 e-Gov法令検索 でご確認いただけます。
<第23条の2の6の2 第2項>
厚生労働大臣は、前項の規定による第23条の2の5の承認に係る医療機器又は体外診断用医薬品の特性その他を勘案して必要があると認めるときは、当該品目に係る同条第3項前段に規定する資料が同項後段の規定に適合するかどうか又は当該医療機器若しくは体外診断用医薬品の製造管理若しくは品質管理の方法が同条第2項第4号に規定する厚生労働省令で定める基準に適合しているかどうかについて、書面による調査又は実地の調査を行うことができる。この場合において、前項の規定による同条の承認を受けようとする者又は同項の規定による同条の承認を受けた者は、当該調査を受けなければならない。
令和4年法律第47号による改正後の医薬品医療機器等法(2022年5月20日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
大事なところをハイライトしています。
ゴチャゴチャしてますので、大事なところだけ抜き出してみましょう。
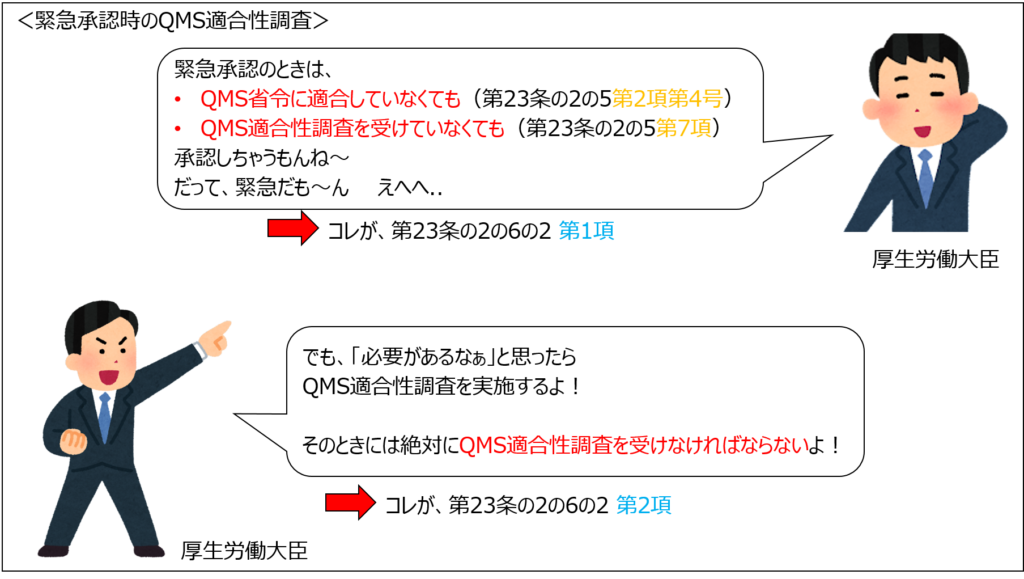
緊急承認では、承認までにかかる時間を最大限に短縮するために、「QMS適合性調査を省略することができる」という規定が法律上整備されています。
一方で厚生労働大臣が必要と認めた場合には、QMS適合性調査を受けなければなりません。
なんとなく理解できたでしょうか?
詳しく見ていきましょう。
承認時にはQMS適合性調査を受けなければならない(基本)
基本的には、全ての承認時には、QMS適合性調査を受けなければなりません。
承認にはいくつかの種類がありますが、「通常承認」や「緊急承認」、「特例承認」、「条件付き承認」等、いずれの場合も、基本的にはQMS適合性調査を受ける必要があります。
医薬品医療機器等法の<第23条の2の5 第7項>で定められています↓↓
<第23条の2の5 第7項>
第1項の承認を受けようとする者又は同項の承認を受けた者は、その承認に係る医療機器又は体外診断用医薬品が政令で定めるものであるときは、その物の製造管理又は品質管理の方法が第2項第4号に規定する厚生労働省令で定める基準に適合しているかどうかについて、当該承認を受けようとするとき、及び当該承認の取得後3年を下らない政令で定める期間を経過するごとに、厚生労働大臣の書面による調査又は実地の調査を受けなければならない。
令和元年法律第63号による改正後の医薬品医療機器等法(2020年9月1日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
<抜粋>
承認を受けようとする者は、承認を受けようとするときに、厚生労働大臣の調査を受けなければならない。
でも、緊急承認時はQMS適合性調査を省略できる
ただ一方で、「緊急承認」では、承認までにかかる時間を最大限に短縮し迅速に承認するために、<第23条の2の5 第7項>の規定にかかわらず、承認を受けることができます。
つまり、QMS適合性調査を受けなくても承認を受けることができます。
医薬品医療機器等法の<第23条の2の6の2 第1項>で定められています↓↓
<第23条の2の6の2 第1項 各号列記以外の部分>
第23条の2の5の承認の申請者が製造販売をしようとする物が、次の各号のいずれにも該当する医療機器又は体外診断用医薬品として政令で定めるものである場合には、厚生労働大臣は、同条第2項(第3号ハに係る部分を除く。)、第6項、第7項、第9項及び第11項の規定にかかわらず、薬事審議会の意見を聴いて、その適正な使用の確保のために必要な条件及び2年を超えない範囲内の期限を付してその品目に係る同条の承認を与えることができる。
令和5年法律第36号による改正後の医薬品医療機器等法(2024年4月1日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
<抜粋>
厚生労働大臣は、同条第2項、第7項、の規定にかかわらず、承認を与えることができる。
ただし、厚生労働大臣が「調査する」と決めたら必ず受ける
上述のとおり、「緊急承認」では、QMS適合性調査を受けていなくても承認を受けることができます。
しかしながら、厚生労働大臣は「必要があると認めるとき」には、QMS適合性調査を実施することができます。
QMS適合性調査の実施が決まった場合には、申請者(製造販売業者)は、必ず調査を受けなければなりません。
医薬品医療機器等法の<第23条の2の6の2 第2項>で定められています↓↓
<第23条の2の6の2 第2項>
厚生労働大臣は、前項の規定による第23条の2の5の承認に係る医療機器又は体外診断用医薬品の特性その他を勘案して必要があると認めるときは、当該品目に係る同条第3項前段に規定する資料が同項後段の規定に適合するかどうか又は当該医療機器若しくは体外診断用医薬品の製造管理若しくは品質管理の方法が同条第2項第4号に規定する厚生労働省令で定める基準に適合しているかどうかについて、書面による調査又は実地の調査を行うことができる。この場合において、前項の規定による同条の承認を受けようとする者又は同項の規定による同条の承認を受けた者は、当該調査を受けなければならない。
令和4年法律第47号による改正後の医薬品医療機器等法(2022年5月20日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
QMS適合性調査の実施が決まったら…
QMS適合性調査の実施が決まった場合には、申請者(製造販売業者)は、必ず調査を受けなければなりません。
QMS適合性調査の申請方法
緊急承認時のQMS適合性調査申請の方法については通知にて示されています。
緊急承認及び特例承認に係るQMS調査の適合性調査申請の取扱いは、「基準適合証及びQMS適合性調査申請等の取扱いについて」(令和2年8月31日薬生監麻発0831第1号薬生機審発0831第16号厚生労働省医薬・生活衛生局監視指導・麻薬対策課長、医療機器審査管理課長連名通知)も参考に、法第23条の2の5第7項に基づくQMS調査申請に準じて実施すること。
「緊急承認及び特例承認に係る適合性調査の取扱いについて」(令和4年5月20日薬生監麻発0520第1号)
原文は 厚生労働省法令等データベースサービス でご確認いただけます。
「通常承認」の際のQMS適合性調査申請と同じように申請をすればよいということですね。
詳細な申請方法については、通知「基準適合証及びQMS適合性調査申請等の取扱いについて」を参考にすればよいようです。
QMS適合性調査の手数料
緊急承認時のQMS適合性調査申請の手数料についても同通知にて示されています。
なお、申請の際の手数料については、手数料令第33条第5項に定める各区分の手数料とし、法第 23条の2の5第7項に基づくQMS調査申請に準じて取り扱うこと。
「緊急承認及び特例承認に係る適合性調査の取扱いについて」(令和4年5月20日薬生監麻発0520第1号)
原文は 厚生労働省法令等データベースサービス でご確認いただけます。
手数料についても「通常承認」のQMS適合性調査申請の際と同額になるようです。
手数料は「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係手数料令」(平成17年政令第91号)の第33条第5項によって定められています。
具体的には、次の図の通りです。
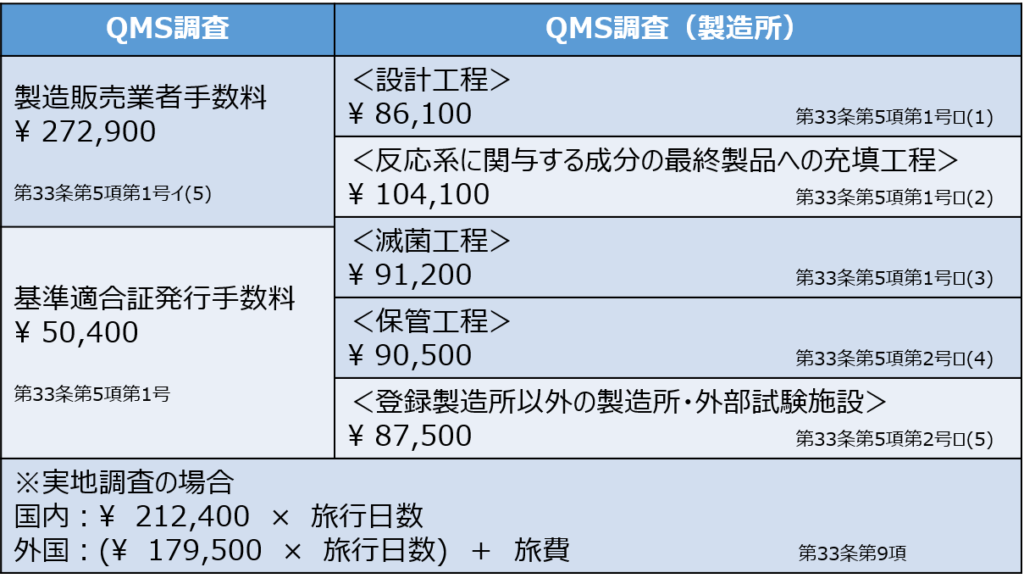
QMS適合性調査の手数料は、図2の該当する金額を全て足し合わせて計算されます。
図3にQMS手数料計算の2つの例を示してみました(書面調査の場合)。
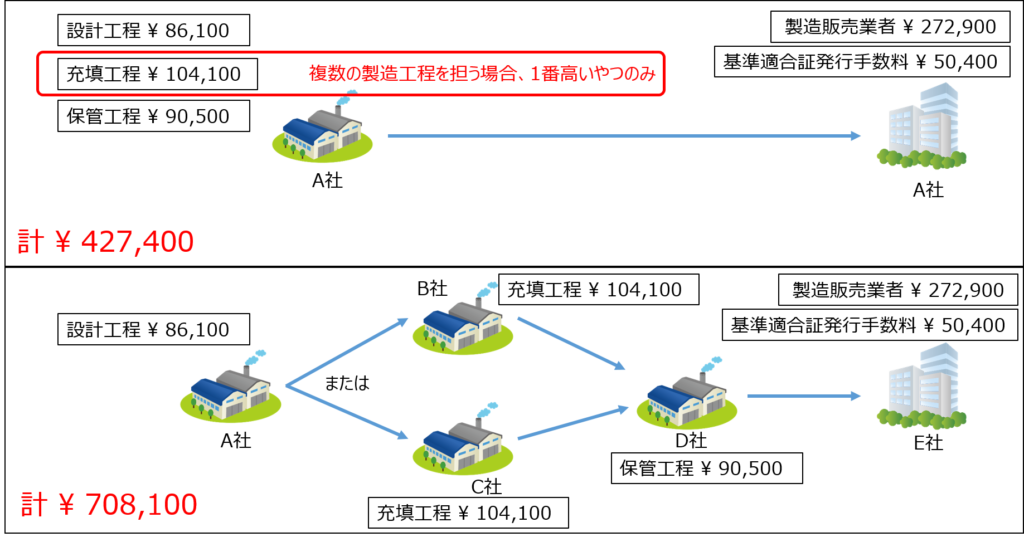
関係する製造所の数が多ければ多いほど、手数料が増えることになります。
QMS適合性調査の手数料については、PMDAから「QMS手数料計算ツール」が出ていますのでこれを活用して算出すると良いでしょう。(PMDAへのQMS適合性調査申請時には「QMS手数料計算ツール」による計算結果の添付が必須ですので、これを使えばOKですね。)
緊急承認時のQMS適合性調査の合理化
「既に適合証を持っていればQMS適合性調査を合理化できる」という話をよく聞きますが、
「緊急承認」で厚生労働大臣が「必要と認めたとき」に実施されるQMS適合性調査は合理化することができるのでしょうか?
「緊急承認」の際に厚生労働大臣が「必要と認めたとき」に実施されるQMS適合性調査は合理化することはできません。
QMS適合性調査の合理化については、医薬品医療機器等法の<第23条の2の5第8項>で定められています↓↓
<第23条の2の5第8項 各号列記以外の部分>
第一項の承認を受けようとする者又は同項の承認を受けた者は、その承認に係る医療機器又は体外診断用医薬品が次の各号のいずれにも該当するときは、前項の調査を受けることを要しない。
令和元年法律第63号による改正後の医薬品医療機器等法(2020年9月1日施行)
原文は 総務省 e-Gov法令検索 でご確認いただけます。
いくつかの条件に該当する場合には、前項の調査(第23条の2の5第7項のQMS適合性調査のこと)を受けることを要しない旨が書かれていますね。
これがQMS適合性調査の合理化の根拠条文となっています。
「第23条の2の5第7項のQMS適合性調査」と書きましたが、条文レベルで見ると、QMS適合性調査にはいくつかの種類があります。

図4のうち、1番目と2番目のQMS適合性調査は「前項の調査(第23条の2の5第7項のQMS適合性調査のこと)」に該当しますので、合理化の対象となります。
一方で、他の3番目~6番目のQMS適合性調査は、「前項の調査(第23条の2の5第7項のQMS適合性調査のこと)」に該当しませんので、合理化の対象とはなりません。
今回の「緊急承認」で厚生労働大臣が「必要と認めたとき」に実施されるQMS適合性調査は、5番目のQMS適合性調査にあたるため、合理化することはできません。

もし「必要と認められたら」、謹んで承りましょう。
まとめ
本ページでは緊急承認の際のQMS適合性調査の省略、合理化ついて、その根拠を実際の法令を見ながら確認しました。
- 緊急承認時はQMS適合性調査が省略可能である。
- ただし、厚生労働大臣が「必要と認めたら」受けなければならない。
- 緊急承認時のQMS適合性調査の申請方法、手数料は通常承認時と同じ。
- また、厚生労働大臣が「必要と認めたら」合理化することはできない。
以上4点、理解いただければ幸いです。

「適合しているかどうか調査を受けなければならない」という規定はあるけど「不適合のときは承認しない」という規定は見当たらない。大丈夫なのだろうか…。
以上です!ありがとうございました!

コメント